Ջուրը կարող է մասնակցել տարբեր քիմիական ռեակցիաների` միացման, քայքայման, տեղակալման, փոխանակման։ Ջուրը փոխազդում է բազմաթիվ պարզ և բարդ նյութերի հետ։
Ջրի փոխազդեցությունը մետաղների հետ
Սենյակային ջերմաստիճանում ջուրը փոխազդում է ալկալիական և հողալկալիական մետաղների հետ:

Լուծույթները և դրանց կոնցենտրացիաները
Լուծույթն այն համասեռ համակարգն է, որը բաղկացած է լուծիչից, լուծված նյութից և դրանց փոխազդեցության արգասիքներից:
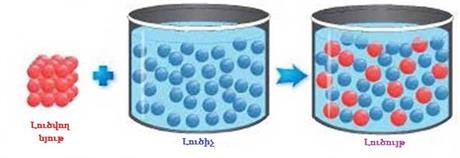
Ջուրը համընդհանուր լուծիչ է:

ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
- Ինչպե՞ս են փոխվում նյութերի խտությունները գազ հեղուկ → պինդ վիճակների անցնելիս.
ա) ցանկացած նյութի դեպքում
Մեծանում է
բ) ջուր նյութի դեպքում
Գազից հեղուկ խտությունը մեծանում է ամենամեծ 4° S=1գ/սմ³, հեղուկից պինդ (սառույց) խտությունը փոքրանում է։
- Սառույցը հեղուկ ջրի փոխարկվելիս ինչպե՞ս է փոխվում ծավալը.
ա) մնում է անփոփոխ
բ) փոքրանում է աննշան չափով
գ) մեծանում է
դ) փոքրանում է զգալի չափով
- Ինչո՞ւ է ջրով լիքը ապակյա փակ շիշը ջարդվում սառցախցիկում պահելիս:
Քանի որ սառույցի խտությունը ավելի փոքր է, քան հեղուկ ջրինը ուստի սառույցի վերածվելիս ծավալը մեծանում է և շիշը ջարդվում է։
- Ինչո՞ւ ամռանը ջրի ջերմաստիճանն էական փոփոխության չի են թարկվում:
Որովետև ջուրը վատ ջերմահաղորդիչ է։
- Որքա՞ն են՝ ա) 18 գ բ) 36 գ) 54 գ զանգվածներով ջրի
ա) նյութաքանակները
ա)m(H20=18գ)
M(H2O)=18գ/մոլ
n?
n=1մոլ
բ)m=36գ
M=18գ/մոլ
n=36/18=2մոլ
գ)m=54գ
M=18գ/մոլ
n=54/18=3մոլ
բ) ծավալները 4°C-ում
ա)m=18գ
S=1գ/սմ³
v?
v=S/m=18գ/1գ/սմ³=18սմ³
բ)m=36գ
S=1գ/սմ³
v?
v=S/m=1գ/սմ³/36գ=36սմ³
գ)m=54գ
S=1գ/սմ³
v?
v=m/S=54գ/1գ/սմ³=54սմ³
- Որքա՞ն է մոլեկուլների թիվը 2 լ ջրում (p= 1գ/մլ։
v=2000մլ
S=1գ/մլ
m?
m=S×v=2000գ
m=2000գ
M=18գ/մոլ
NԱ=6,02×10²³
N?
m/M=N/NԱ
N=m×NԱ/M=2000×6,02×10²³/18=668,9×10²³=669×10²⁵մոլեկուլ։
- Ի՞նչ ծավալով (լ,ն.պ.) ջրածին կանջատվի 90 գ ջրի և 80 գ կալցիումի փոխազդեցությունից:
2H2O+Ca=Ca(OH)2+H2
n(H2O)=m/M=90գ/18=5մոլ-ավելցուկով
n(Ca)=80գ/40=2մոլ
2մոլ/1մոլ
xլ/22,4լ
x=2×22,4=44,8լ(H2)
- Մագնեզիումի և սիլիցիումի խառնուրդն առանց օդի մուտքի շիկաց– նելիս ստացվում է աղանման նյութ, որը ջրով քայքայվում է՝ առաջացնելով սիլան’ SiH4, գազը: Ի՞նչ քանակով (մոլ) մագնեզիում կպահանջվի 33,6 լ (ն.պ.) սիլան ստանալու համար: